
Una empresa biofarmacéutica demuestra la fiabilidad de MEGAcel® II
- BioTechnique™ es un fabricante estadounidense de productos biofarmacéuticos de alta potencia y citotóxicos, estériles e inyectables
- Se encuentra situada en Madison, Wisonsin (EE. UU.)
- BioTechnique manufactures:
- Sistemas de dosificación inyectables, estériles y de alto valor, en formato líquido y liofilizado, para virus vivos debilitados, conjugados farmacológicos de anticuerpos, nanopartículas y citotóxicos.
- Productos no susceptibles de esterilización en terminales que presentan retos de manipulación específicos para la salud y la seguridad ambiental para el personal encargado de manipularlos durante la fabricación.
El tratamiento del aire suponía un problema particular para las instalaciones de BioTechnique, dado que todos los productos que produce la empresa deben fabricarse en un entorno aséptico. Si un filtro HEPA se ve comprometido y no ofrece una reducción mínima del 99,97 % de partículas no viables, puede provocar un posible crecimiento microbiano en un producto que se supone que debe ser estéril. Los análisis de evaluación de riesgos mostraron un potencial impacto crítico en pacientes en caso de uso de productos no estériles, algo que resulta inaceptable.
A HEPA breach can be detected during the prescribed AQL sterility sampling of the product, during required environmental monitoring, or during the biannual HEPA certification process. However, a more substantial engineering solution was needed to ensure that the products manufactured by BioTechnique maintained the highest possible quality standards. After the product is formulated, filled, inspected, labelled, packaged, tested and released, there is no more opportunity to detect a quality issue. BioTechnique management therefore mandated, after assessing the potential impact to patient safety, that the Engineering Department seek a solution to improve the reliability of the manufacturing process and the quality of the product, while at the same time reducing the facility’s energy consumption.
In late 2014, the company embarked on a Lean Six Sigma project to improve the reliability of its manufacturing facility and reduce the energy costs of maintaining the Grade A (ISO 5), Grade B (ISO 6), Grade C (ISO 7) and Grade D (ISO 8) areas. National and local energy incentives, such as the State of California Title 24 programme, have encouraged many pharmaceutical firms like BioTechnique to initiate energy conservation projects.

BioTechnique undertook an engineering study to determine the return on investment by purchasing the new PAO compliant ePTFE filter media, compared to traditional glass media. The study was designed to determine the optimal filter pack depth of the ePTFE filter media to install, relative to the legacy microglass filter media.
To ensure no statistical bias, BioTechnique constructed a test rig that would allow testing in a controlled environment, ensuring that the testing methodology was statistically sound and reproducible, and would produce meaningful data to draw a defendable conclusion. The study was composed of tests that were conducted three times, each time using three filters of each type, including two traditional microglass HEPAs and the 50mm and 75mm ePTFE HEPA filters. This study therefore utilised 36 different tests, resulting in a statistically meaningful study.
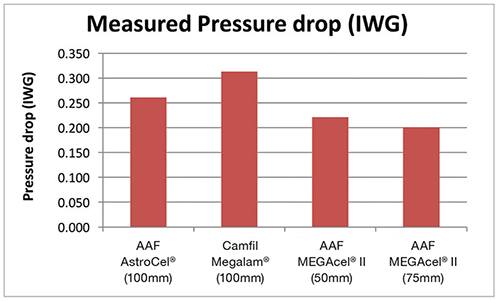
This graph represents the data collected in February 2015 for the four filter types. The ePTFE 50mm had approximately 30% less pressure drop than the 100mm microglass HEPA. The ePTFE 75mm had a 36% less pressure drop than the 100mm traditional microglass HEPA.
BioTechnique calculated the total projected annual energy savings due to the lower pressure drop ePTFE HEPA filters to be 9,350 kWh.
In October 2015, two competing sets of filters (AAF MEGAcel® II and Camfil Megalam®) were installed in two separate ISO 5 critical rooms and tested for FDA Certification multiple times.
Throughout the test run, MEGAcel II filters responded with a perfect 100% first pass success rate, while the Camfil filters recorded a disappointing 10.8% failure rate, requiring the filters to be replaced and retested.
The results confirmed that AAF's MEGAcel II Pharmaceutical Grade ePTFE Filtration Technology is not only completely PAO compatible, it also performs at the highest level in critical areas.
Dado que los filtros MEGAcel II eran bastante más ligeros, la instalación fue realizada por una sola persona, mientras que la instalación de los filtros HEPA de microfibra de vidrio requirió la presencia de dos personas. Este ahorro en mano de obra fue especialmente importante por el hecho de que había que instalar una cantidad importante de filtros. El filtro se podía sujetar con una mano y el destornillador con la otra, lo que permitía una instalación rápida. Otra ventaja fue el ausencia de estrés durante la instalación: gracias a que el filtro era más robusto y resistente, la preocupación por que pudiese sufrir algún daño era menor.

Estas pruebas demostraron que los filtros HEPA que contaban con medios filtrantes de ePTFE eran bastante más resistentes y fiables que los que disponían de medios filtrantes de microfibra de vidrio.
- Los filtros MEGAcel II de AAF superaron a los de la competencia con una certificación 100 % a prueba de fugas.
- Los filtros de ePTFE redujeron el número de fallos y de salidas de control ambiental, lo que supuso menos pérdidas de fabricación y costes de mano de obra inferiores.
- El uso de los filtros de ePTFE aumentó el tiempo entre los procesos para nuevas certificaciones de BioTechnique, aumentando así el tiempo de funcionamiento de las salas blancas.
- El peso ligero de los filtros MEGAcel II permitió una instalación más rápida, lo que supuso una ventaja en términos de ahorro en mano de obra.
- Los medios filtrantes de ePTFE ofrecen una pérdida de presión muy inferior a la de los medios filtrantes tradicionales de microfibra de vidrio, lo que supone un importante ahorro energético para las salas blancas de Grado A y B.
- BioTechnique™ es un fabricante estadounidense de productos biofarmacéuticos de alta potencia y citotóxicos, estériles e inyectables
- Se encuentra situada en Madison, Wisonsin (EE. UU.)
- BioTechnique manufactures:
- Sistemas de dosificación inyectables, estériles y de alto valor, en formato líquido y liofilizado, para virus vivos debilitados, conjugados farmacológicos de anticuerpos, nanopartículas y citotóxicos.
- Productos no susceptibles de esterilización en terminales que presentan retos de manipulación específicos para la salud y la seguridad ambiental para el personal encargado de manipularlos durante la fabricación.
El tratamiento del aire suponía un problema particular para las instalaciones de BioTechnique, dado que todos los productos que produce la empresa deben fabricarse en un entorno aséptico. Si un filtro HEPA se ve comprometido y no ofrece una reducción mínima del 99,97 % de partículas no viables, puede provocar un posible crecimiento microbiano en un producto que se supone que debe ser estéril. Los análisis de evaluación de riesgos mostraron un potencial impacto crítico en pacientes en caso de uso de productos no estériles, algo que resulta inaceptable.
A HEPA breach can be detected during the prescribed AQL sterility sampling of the product, during required environmental monitoring, or during the biannual HEPA certification process. However, a more substantial engineering solution was needed to ensure that the products manufactured by BioTechnique maintained the highest possible quality standards. After the product is formulated, filled, inspected, labelled, packaged, tested and released, there is no more opportunity to detect a quality issue. BioTechnique management therefore mandated, after assessing the potential impact to patient safety, that the Engineering Department seek a solution to improve the reliability of the manufacturing process and the quality of the product, while at the same time reducing the facility’s energy consumption.
In late 2014, the company embarked on a Lean Six Sigma project to improve the reliability of its manufacturing facility and reduce the energy costs of maintaining the Grade A (ISO 5), Grade B (ISO 6), Grade C (ISO 7) and Grade D (ISO 8) areas. National and local energy incentives, such as the State of California Title 24 programme, have encouraged many pharmaceutical firms like BioTechnique to initiate energy conservation projects.

BioTechnique undertook an engineering study to determine the return on investment by purchasing the new PAO compliant ePTFE filter media, compared to traditional glass media. The study was designed to determine the optimal filter pack depth of the ePTFE filter media to install, relative to the legacy microglass filter media.
To ensure no statistical bias, BioTechnique constructed a test rig that would allow testing in a controlled environment, ensuring that the testing methodology was statistically sound and reproducible, and would produce meaningful data to draw a defendable conclusion. The study was composed of tests that were conducted three times, each time using three filters of each type, including two traditional microglass HEPAs and the 50mm and 75mm ePTFE HEPA filters. This study therefore utilised 36 different tests, resulting in a statistically meaningful study.

This graph represents the data collected in February 2015 for the four filter types. The ePTFE 50mm had approximately 30% less pressure drop than the 100mm microglass HEPA. The ePTFE 75mm had a 36% less pressure drop than the 100mm traditional microglass HEPA.
BioTechnique calculated the total projected annual energy savings due to the lower pressure drop ePTFE HEPA filters to be 9,350 kWh.
In October 2015, two competing sets of filters (AAF MEGAcel® II and Camfil Megalam®) were installed in two separate ISO 5 critical rooms and tested for FDA Certification multiple times.
Throughout the test run, MEGAcel II filters responded with a perfect 100% first pass success rate, while the Camfil filters recorded a disappointing 10.8% failure rate, requiring the filters to be replaced and retested.
The results confirmed that AAF's MEGAcel II Pharmaceutical Grade ePTFE Filtration Technology is not only completely PAO compatible, it also performs at the highest level in critical areas.
Dado que los filtros MEGAcel II eran bastante más ligeros, la instalación fue realizada por una sola persona, mientras que la instalación de los filtros HEPA de microfibra de vidrio requirió la presencia de dos personas. Este ahorro en mano de obra fue especialmente importante por el hecho de que había que instalar una cantidad importante de filtros. El filtro se podía sujetar con una mano y el destornillador con la otra, lo que permitía una instalación rápida. Otra ventaja fue el ausencia de estrés durante la instalación: gracias a que el filtro era más robusto y resistente, la preocupación por que pudiese sufrir algún daño era menor.

Estas pruebas demostraron que los filtros HEPA que contaban con medios filtrantes de ePTFE eran bastante más resistentes y fiables que los que disponían de medios filtrantes de microfibra de vidrio.
- Los filtros MEGAcel II de AAF superaron a los de la competencia con una certificación 100 % a prueba de fugas.
- Los filtros de ePTFE redujeron el número de fallos y de salidas de control ambiental, lo que supuso menos pérdidas de fabricación y costes de mano de obra inferiores.
- El uso de los filtros de ePTFE aumentó el tiempo entre los procesos para nuevas certificaciones de BioTechnique, aumentando así el tiempo de funcionamiento de las salas blancas.
- El peso ligero de los filtros MEGAcel II permitió una instalación más rápida, lo que supuso una ventaja en términos de ahorro en mano de obra.
- Los medios filtrantes de ePTFE ofrecen una pérdida de presión muy inferior a la de los medios filtrantes tradicionales de microfibra de vidrio, lo que supone un importante ahorro energético para las salas blancas de Grado A y B.

 FHK Polska
FHK Polska PureMedion Kft.
PureMedion Kft. Elfa spol. s r. o.
Elfa spol. s r. o. Ecotip d.o.o.
Ecotip d.o.o.

